暂无数据
实验原理:
本试剂盒采用双抗体夹心法酶联免疫吸附试验(ELISA)。往预先包被有人IgE-Fc片段受体Ⅱ (FceRⅡ)捕获抗体的微孔中,依次加入样本、标准品、生物素标记的检测抗体,HRP酶结合物,中间经过温育和洗涤,用底物TMB显色,TMB在过氧化物酶(HRP)的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。颜色的深浅和样本中的人IgE-Fc片段受体Ⅱ (FceRⅡ)呈正相关。用酶标仪在450nm 波长下测定吸光度(OD值),计算样本浓度。
试剂盒组成:
| 名称 | 96孔配置 | 48孔配置 | 备注 |
| 预包被96孔酶标板 Pre-coated Assay Plate | 8孔×12条 | 8孔×6条 | 无 |
| 标准品 Standard | 2支 | 1支 | 按说明书进行稀释 |
| 通用稀释液 Universal Diluent | 2x20mL | 1x20mL | 无 |
| 浓缩生物素化检抗100× Biotin-antibody (100×) | 120μL | 60μL | 按说明书进行稀释 |
| 浓缩酶结合物 100× Streptavidin-HRP (100×) | 120μL | 60μL | 按说明书进行稀释 |
| 20×洗涤液 Wash Buffer (20×) | 2x10mL | 1x10mL | 按说明书进行稀释 |
| 底物(TMB) TMB Substrate | 10mL | 5mL | 无 |
| 终止液 Stop Solution | 6mL | 3mL | 无 |
| 封板膜 Plate Sealer | 4张 | 4张 | 无 |
| 说明书 Instruction Manual | 1份 | 1份 | 无 |
试剂盒参数:
| 性能 | |
| 灵敏度 | 0.10ng/mL |
| 检测范围 | 0.31-20ng/mL |
| 特异性 | 可检测样本中人的FceRⅡ,且与其类似物无明显交叉反应. |
需自备的设备及试剂:
1. 450±10nm 滤光片酶标仪
2. 高精度加样器及枪头:0.5-10uL、2-20uL、20-200uL、200-1000uL.
3. Eppendorf 移液器.
4. 蒸馏水或去离子水.
5. 脱脂棉吸水纸.
6. 37℃恒温箱.
8. 准备若干个标准品稀释管.
样本稀释方案:
请提前预估样本的浓度范围,如果您的检测样本需要稀释,参考稀释方案如下:
稀释 100 倍:一步稀释。取 5μL 样本到 495μL 通用稀释液内,做 100 倍稀释;
稀释 1000 倍:两步稀释。取 5μL 样本到 95μL 通用稀释液内,做 20 倍稀释,再取 5μL 20倍稀释样本到 245μL通用稀释液内,做50倍稀释,总共稀释 1000 倍;
稀释 100000 倍:三步稀释。取5μL样本到195μL通用稀释液内,做40倍稀释,再取5μL 40 倍稀释样本到 245μL 通用稀释液内,做50倍稀释,最后取5μL 2000 倍稀释样本到 245μL 通用稀释液内,做 50 倍稀释,总共稀释100000 倍;
每步稀释时取液量不少于 3μL,稀释倍数不超过 100 倍。每步稀释都需混合均匀,避免起泡。
样本处理及要求:样本处理及要求:
1. 试剂盒检测范围不等同于样本中待测物的浓度范围,建议实验前通过相关文献预估样本中待测物的浓度并通过预实验确定样本的实际浓度情况。如果样品中待测物浓度过高或过低,请对样本做适当的稀释或浓缩。
2. 若所检样本不在说明书所列样本之中,建议做预实验验证其检测有效性。
3. 血清:将收集于血清分离管的全血标本在室温放置 2 小时或 4℃过夜,然后 1000×g 离心 20 分钟,取上清即可,或将上清置于-20℃或-80℃保 存,但应避免反复冻融。
4. 血浆:用 EDTA 或肝素作为抗凝剂采集标本,并将标本在采集后的 30 分钟内于 2-8℃1000×g 离心 15 分钟,取上清即可检测,或将上清置于 -20℃或-80℃保存,但应避免反复冻融。
5. 组织匀浆:用预冷的 PBS (0.01M, pH=7.4)冲洗组织,去除残留血液(匀浆中裂解的红细胞会影响测量结果),称重后将组织剪碎。将剪碎的组织与对应体积的 PBS(一般按1:9 的重量体积比,比如 1g 的组织样品对应 9mL 的 PBS,具体体积可根据实验需要适当调整,并做好记录。推荐 在 PBS 中加入蛋白酶抑制剂)加入玻璃匀浆器中,于冰上充分研磨。为 了进一步裂解组织细胞,可以对匀浆液进行超声破碎,或反复冻融。最后将匀浆液于 5000×g 离心5~10 分钟,取上清检测。
6. 细胞培养物上清:请 1000×g 离心 20 分钟,取上清即可检测,或将上清置于-20℃或-80℃保存,但应避免反复冻融。
7. 其它生物标本:1000×g 离心 20 分钟,取上清即可检测。
8. 样品外观:样品应清澈透明,悬浮物应离心去除。
9. 样品保存:样品收集后若在 1 周内进行检测的可保存于 4℃,若不能及时检测,请按一次使用量分装,冻存于-20℃(1 个月内检测),或-80℃(6 个月内检测),避免反复冻融,标本溶血会影响最后检测结果,因此溶血标本不宜进行此项检测。
检测前准备工作:
1. 请提前10分钟从冰箱中取出试剂盒,平衡至室温。
标准品梯度工作液配制:加入1mL通用稀释液至冻干标准品中,静置15分钟待其完全溶解后轻轻混匀(浓度为:20ng/mL),然后按照以下浓度:20ng/mL、 10ng/mL、5ng/mL、2.5ng/mL、 1.25ng/mL、0.62ng/mL、0.31ng/mL、0ng/mL进行稀释。
倍比稀释方法:取7支 EP管,每管中加入500μL通用稀释液,:20ng/mL的标准品工作液中吸取500μL到第一支EP管中混匀配成10ng/mL的标准品工作液,按此步骤往后依次吸取混匀。最后一管直接作为空白孔,不需要再从倒数第二管中吸取液体,具体如下图。

3. 生物素化检抗工作液配制:使用前 15 分钟将浓缩生物素化抗体于 1000×g 离心 1 分钟,以通用稀释液将 100×浓缩生物素化抗体稀释成 1×工作浓 度(例:10μL 浓缩液+990μL通用稀释液),当日使用
4. 酶结合物工作液配制:使用前 15 分钟将 100x 浓缩酶结合物于 1000×g 离心 1 分钟,以通用稀释液将 100×浓缩 HRP 酶结合物稀释成 1×工作浓 度(例:10μL 浓缩液+990μL通用稀释液),当日使用。
5. 1×洗涤液配制:取 10mL 20×洗涤液到190mL蒸馏水中(从冰箱中取出的浓缩洗涤液可能有结晶,属于正常现象,可放置室温,轻摇均匀,待结 晶完全溶解后再配置)。
操作步骤:
1. 从室温平衡 10 分钟后的铝箔袋中取出所需板条,剩余板条用自封袋密封放回 4℃。
2. 加样:分别将样品或不同浓度标准品按照 100μl 每孔加入相应孔中 ,空白孔加入100μL 通用稀释液。盖上封板膜后 37℃温育1小时。(建议: 将待测样本用通用稀释液最低稀释1 倍后再加入酶标内测试。从而减少基质效应对测试结果的误差影响 ,最后计算样本浓度时需乘以对应的 稀释倍数。所有的待测样本和标准品在检测中建议设立复孔)。
3. 加生物素化抗体:取出酶标板,弃去液体,不用洗涤。每孔直接加入生物素化抗体工作液 100μL,盖上封板膜后 37℃温育 1 小时。
4. 洗板:弃去液体,每孔加入 300μL 1x 洗涤液,静置 1 分钟,甩去洗涤液,吸水纸上拍干,如此重复洗板 3 次(也可用洗板机洗板)。
5. 加酶结合物工作液:每孔加入酶结合物工作液 100μL,盖上封板膜后37℃温育30分钟。
6. 洗板:弃去液体按步骤4洗涤方法,洗板 5 次
7. 加底物:每孔加入底物(TMB)90μL,盖上封板膜,37℃避光温育 15 分钟。
8. 加终止液:每孔加入终止液50μL,立即在 450nm 波长处测定各孔的OD值。
结果判断:
1. 计算标准品和样本复孔的平均OD值并减去空白孔的OD值作为校正值。 以浓度为横坐标 ,OD 值为纵坐标 ,在双对数坐标纸上绘出四参 数逻辑函数的标准曲线。
2. 若样品OD值低于标准曲线上限,应适当稀释后重测并在计算样本浓度时乘以相应的稀释倍数。
典型数据和参考曲线:
以下数据和曲线仅供参考,实验者需根据自己的实验建立标准曲线。
| 浓度(ng/mL) | 20 | 10 | 5 | 2.5 | 1.25 | 0.62 | 0.31 | 0 |
| OD 值 | 2.44 | 1.87 | 1.29 | 0.83 | 0.58 | 0.38 | 0.27 | 0.08 |
| 校正 OD 值 | 2.36 | 1.79 | 1.21 | 0.75 | 0.5 | 0.3 | 0.19 | - |
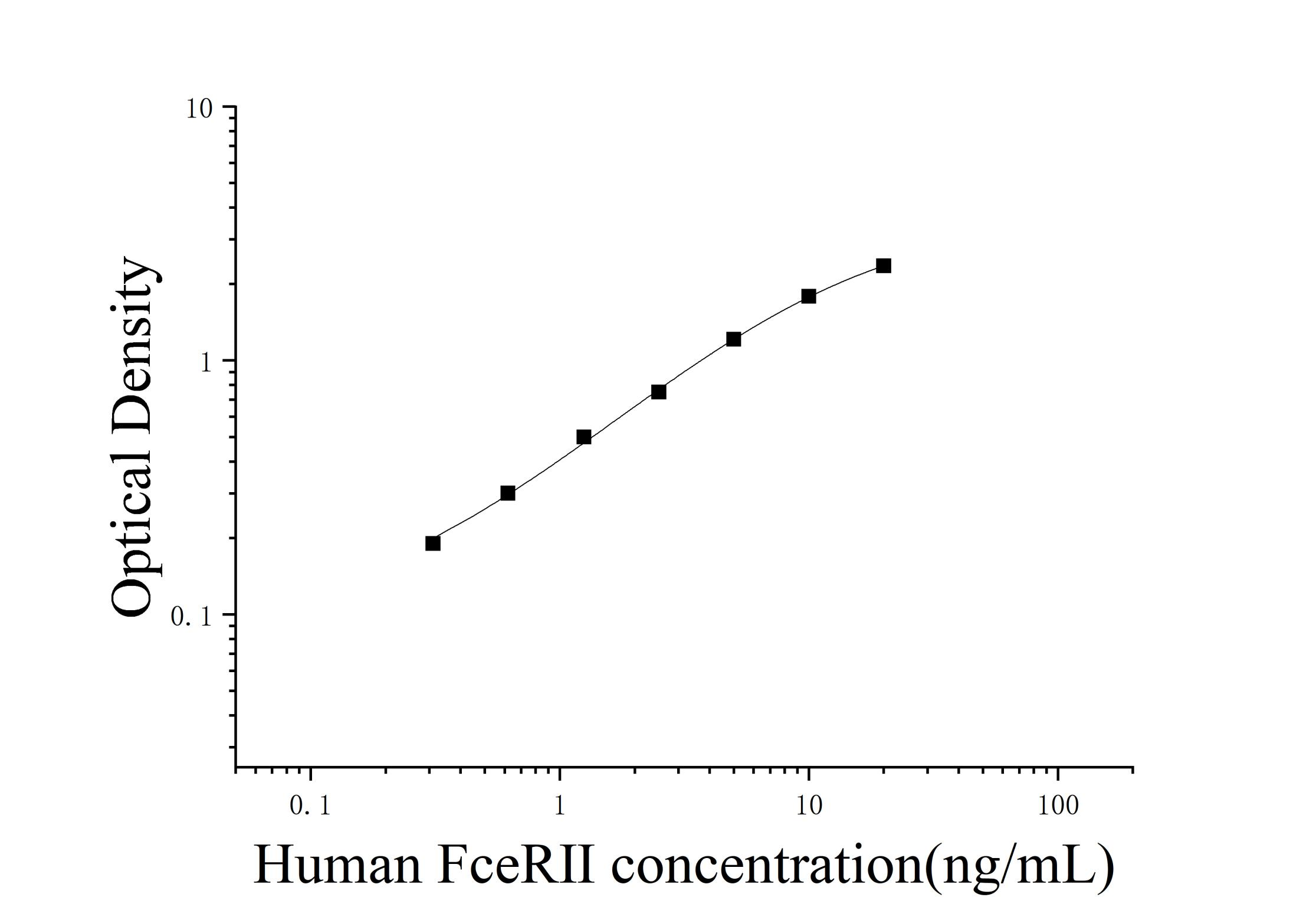
注意:本图仅供参考,应以同次试验标准品所绘标准曲线计算标本含量。
试剂盒性能:
1. 重复性:板内变异系数小于10%,板间变异系数小于10%。
2. 回收率:在选取的健康人血清、血浆中加入3个不同浓度水平的人FceRⅡ,计算回收率
| 样本类型 | 范围( %) | 平均回收率( %) |
| 血清(n=8) | 84-101 | 96 |
| 血浆(n=8) | 92-105 | 102 |
3. 线性稀释:分别在选取的 4 份健康人血清、血浆中加入高浓度人 FceRⅡ ,在标准曲线动力学范围内进行稀释 ,评估线性。
| 稀释比例 | 回收率( %) | 血清 | 血浆 |
| 1 :2 | 范围 |
84-95 |
88-96 |
| 平均回收率( %) |
91 |
93 | |
| 1 :4 | 范围 |
89-103 |
87-108 |
| 平均回收率( %) | 93 | 98 |










